2025年7月23日に開催された令和7年度第2回厚生科学審議会医薬品医療機器制度部会において、GCP省令及び治験広告の見直しに関する議論が実施されました(資料はこちら)。
今回は、制度部会でのこれまでの議論、とりまとめ(2025年1月10日)を踏まえて、見直しに関する論点の詳細が提示されています。
この内容は、今後のGCP省令の改正及び治験の広告の見直しの重要なポイントとなってきますので、整理しておきます。
GCP省令の見直し
GCP省令の見直しについて、各項目のスライドが用意されていますので、それぞれ掲載します。
最初に今回見直しを想定している主な項目が一覧で示されています。シングルIRB活用のための改正、DCT(分散型治験)の実施に向けた改正、治験副作用等のPMDA報告の整理、治験依頼者によるSMO(治験施設支援機関)の監督強化が挙がっています。なお、ICH-E6(R3)の内容の反映もその他として明示されています。

まず、シングルIRBの活用推進について、現行ではIRB審議は医療機関からIRBに依頼していますが、今後の改正により、治験依頼者から直接IRBに対してIRB審議を依頼できるようになります。従来通りの医療機関を介す手続きも残ることになりますが、厚労省としては治験依頼者による直接の依頼を推していることが見て取れます。
加えて、治験関連文書(説明文書等)の作成主体が治験依頼者に移行することも重要な改正点です。
総じて、これらの改正は、実施医療機関の手続的役割の縮小、治験依頼者の責任範囲・業務負担の拡大/見直しが生じるものの、治験全体の最適化に寄与するものと考えます。
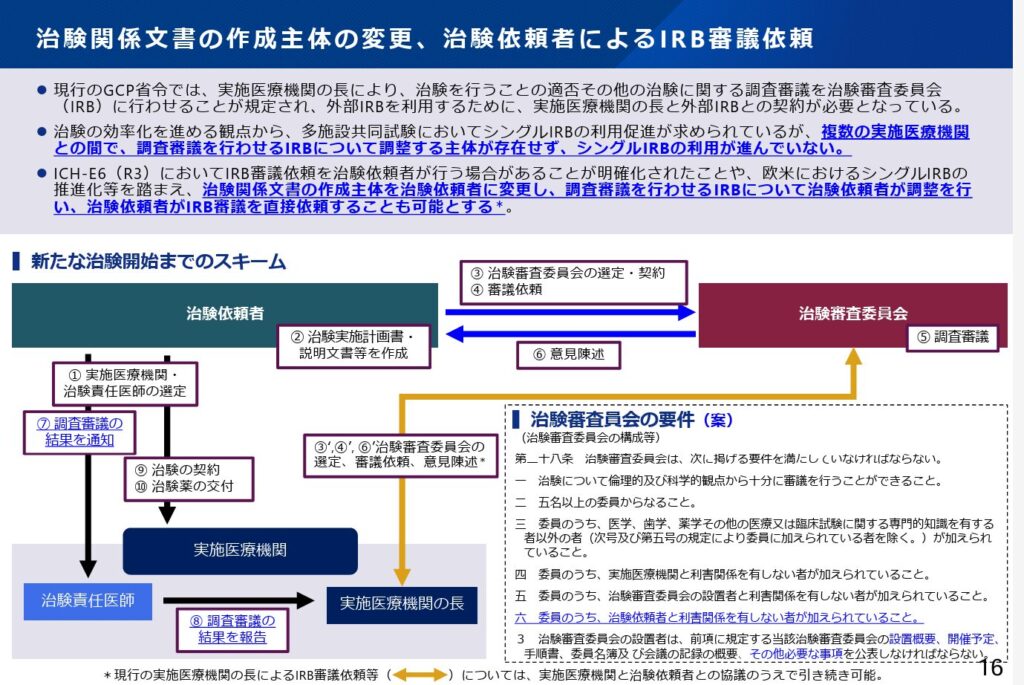
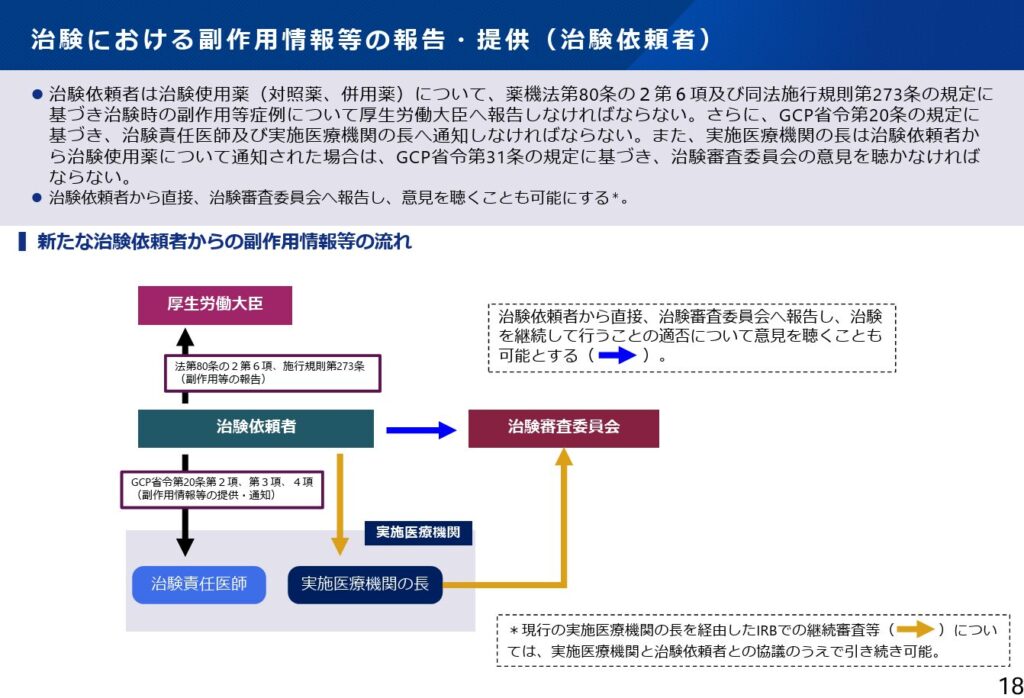
さらに、治験の副作用等報告についても、治験依頼者が直接IRBに報告できるような仕組みが提示されています。この改正も従前の実施医療機関からの報告の手順も残すことが可能とされていますが、セントラルIRBの活用が進むと、治験依頼者による直接報告ルートのほうが迅速性・一貫性・制度整合性の面で優位に働く可能性が高く、主流化することが予想されます。
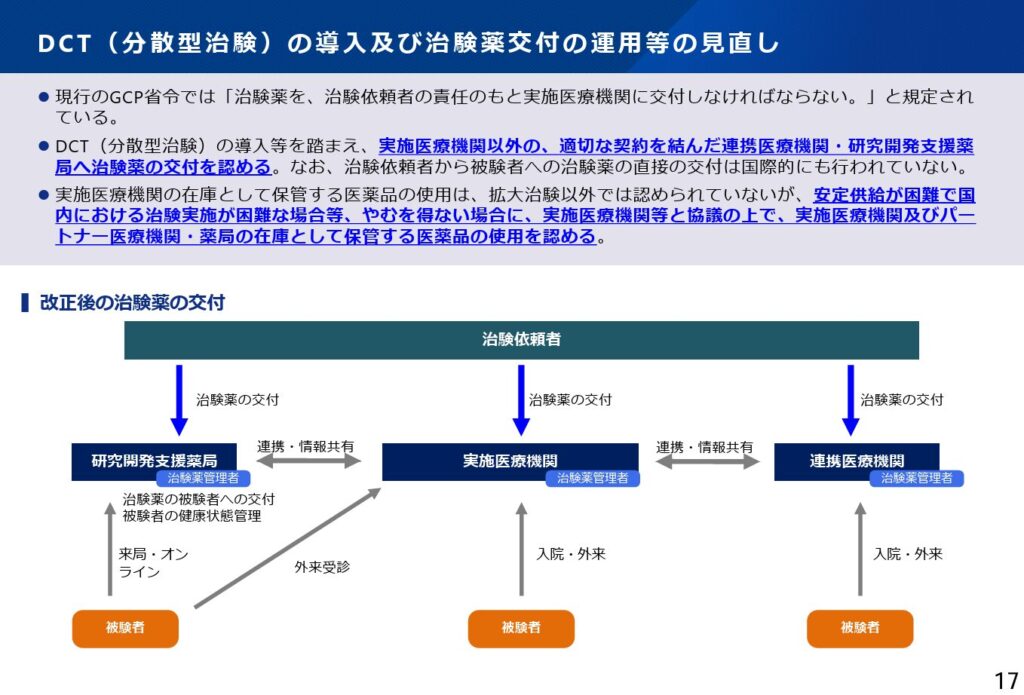
続いて、DCT(分散型治験)に関連して、治験薬の交付に関する規制の見直しが提示されました。現行では治験薬は治験依頼者→実施医療機関→治験参加者という順で交付されます。今回の見直しにより「適切な契約を結んだ」実施医療機関以外の医療機関(連携医療機関、パートナー医療機関)や薬局を介した交付が可能となります。したがって、治験実施の柔軟性向上や患者利便性の向上に資する前向きな改正と評価できます。
ただし、以下の資料になお書きとして、治験依頼者から治験参加者への治験薬の直接交付は国際的にも行われていない旨が示されています。すなわち、治験依頼者から治験参加者への直接交付は引き続き認めない方向で厚労省は考えています。ここは、DCTのさらなる発展と患者中心の治験体制の構築という観点から、むしろ日本が国際的に先駆けて検討・実装に踏み出す意義もあったのではないかと考えられます。
副作用については、いろいろと細かい資料がありますが、治験使用薬について、国内既承認の場合、海外臨床試験における副作用情報をPMDAや医療機関に報告しなくてもよい、という改正を行うことがポイントととなります。


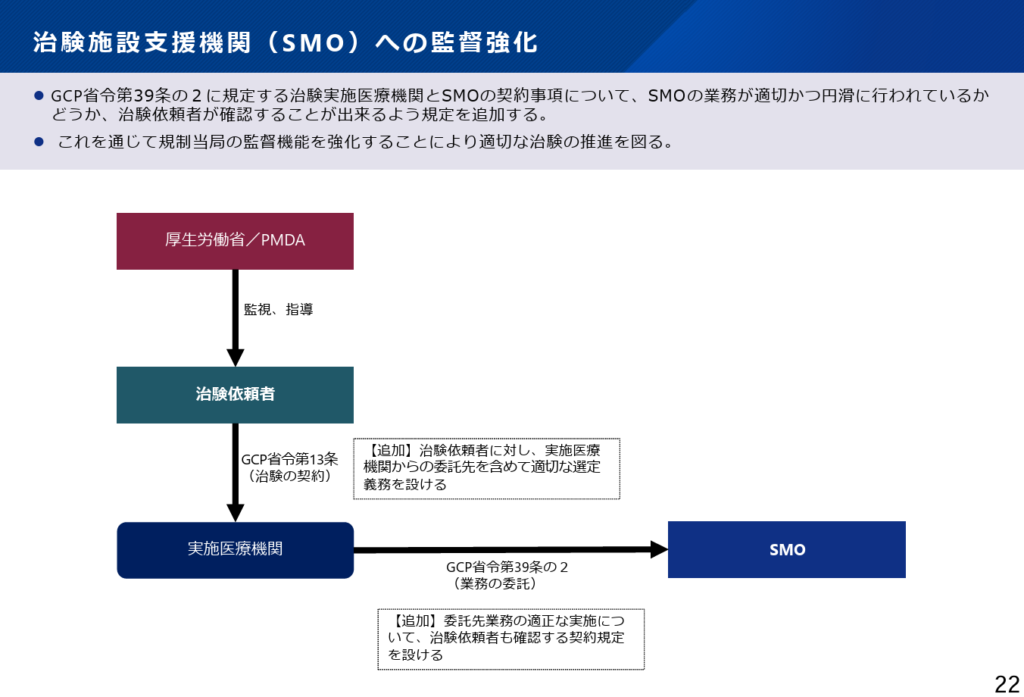
最後に、SMO(治験施設支援機関)への監督強化です。これは、昨今のSMOによる不祥事を踏まえて、導入が検討された規定になります。
今回の強化において重要な点は、厚生労働省やPMDAによる外部的な監視強化ではなく、治験依頼者が契約を通じてSMOを主体的に監督できるようにするという方向性が明示されていることです。制度上は、「監督できる」との表現を用いていますが、実質的には、治験依頼者による積極的な監督体制の構築と運用が求められる内容となっています。
これにより、治験依頼者には以下のような負担や責務の増加が想定されます:
- SMO業務の品質管理や適法性確認のための点検体制の構築
- 不適切事例発生時の対応フローの整備と事前説明
- 社内規程・SOPとの整合性確保および職員教育
したがって、各企業は、今回の改正に伴い、SMOとの契約・運用体制を抜本的に見直す必要性が高まると考えられます。本規定は形式的には「できる規定」とされていますが、制度運用上は事実上の「すべき規定」として機能する可能性が高く、企業側も早期に対応方針の策定と関係部門との連携強化を進めることが求められることになりそうです。
治験の広告規制の見直し
治験の広告規制については、制度部会のとりまとめでは記載がありませんでしたが、薬機法改正法の国会審議の中で議論があったとして、本制度部会でフォローされています。

治験に関する広告規制の見直しにおいて、新たな方向性が提示されました。具体的には、以下の2点に関して、製薬企業等による情報提供の積極的な実施を可能にするよう制度の明確化が提案されています。
第一に、治験参加者の募集に関する情報提供について、製薬企業等が自ら治験情報を積極的に発信できるよう、規制の解釈・運用を整理する方針が示されています。
第二に、治験結果の情報提供についても、規制の枠組みを再確認・明確化することが提案されています。
これらの見直しは、通知レベルでの運用の明確化が想定されていると読めます。この明確化により、製薬企業や患者団体は新たな広報・啓発活動が可能となります。
他方、資料の末尾では「一定の留意が必要」とする厚生労働省の懸念も示されています。企業による過度な表現や誤認を招きかねない情報提供はリスクがあるため、運用明確化にあたってまさに適当な対処がなされることを期待しています。



コメント