2024年4月18日の令和6年度第1回厚生科学審議会医薬品医療機器制度部会から、次期薬機法改正の議論が開始されています(関連記事)。
2024年10月31日に令和6年度第8回会議が開催となりました。前回の第7回に続き、これまでに本部会で議論されたいくつかのトピックについて、追加の議論が行われていますので、重要なポイントをまとめておきます。
会議資料は、こちらのものがメインとなります。
GMP調査の見直し
医薬品の製造所に対するGMP調査について、頻度、方法の見直しが提案されています。

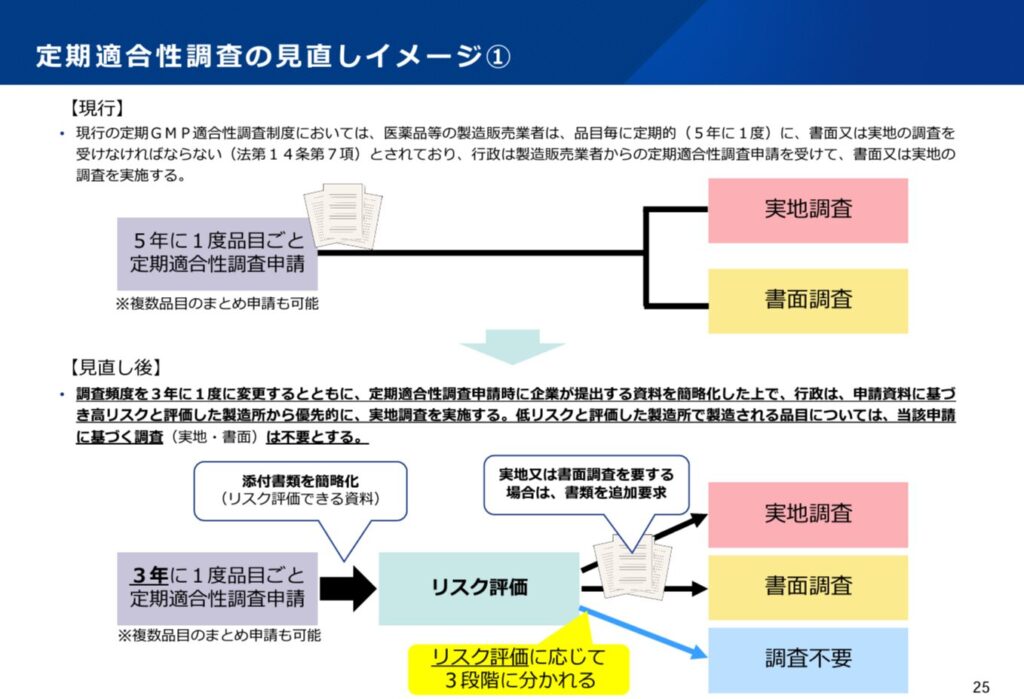
大きな運用変更は、以下の3点となります。
- 新薬や後発医薬品の新規承認申請時は、原則、実地調査
- 定期適合性調査は3年に1回
- リスク評価により調査不要の場合あり
いずれも企業側のGMP調査対応に大きな影響を与えそうな運用となりそうです。
まず、1点目ですが、後発医薬品の新規の際も原則実地調査となると実地調査の頻度は増えそうです。企業側としては、実施調査を想定した費用、準備を想定していくことになりそうです。一方で、PMDA側では調査負担が増えることになりそうです。特に、後発医薬品の新規承認時の調査については、後ほど述べますが、都道府県ではなくPMDAが実施する旨が引き続き提案されています。
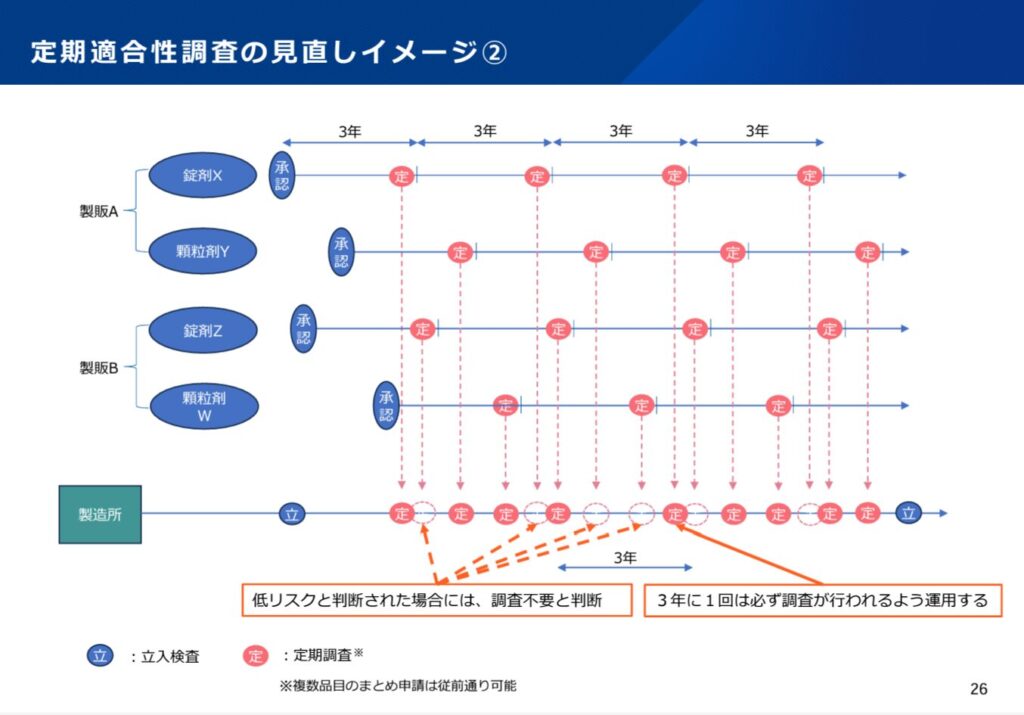
2点については、定期適合性調査の頻度が現行の5年に1回から3年に1回となりますので、純粋に調査(調査申請)の頻度が増え、産官とも調査の準備、対応に必要なリソースが増えるということになります。
ただし、3点目のリスク評価の導入により、必要なところに必要な調査が実施されるようにリソースが配分されることが期待されます。定期適合性調査の申請時にリスク評価により、「実地調査」、「書面調査」、「調査なし」のいずれかの判断がされることになります。「調査なし」という新たな分類が導入されることにより、メリハリのついた対応が期待されます。ただし、リスク評価は品目や製造所の特性に応じての判断となっているものの、いずれにせよ、3年に1回は各製造所に調査(実地調査又は書面調査)が実施されることに留意が必要です。また、今回の資料では、製造所の過去の実績が考慮される旨は明示されていません。すなわち、過去の調査で指摘事項がなかった等の状況であっても、「調査なし」とはならない可能性があります。
一連の品質問題に伴う対応となりますので、GMP調査対応の強化の方向性ではありますので、強化しつつ対応可能な範囲でどう運用していくかをよく吟味した方向性になっています。
PMDAによるGMP調査の拡大
こちらは第4回会議において、大いに議論(都道府県が反対)された内容の続きになります(関連記事)。前回の議論を踏まえて、方向性の修正が行われています。

今回の方向性提案のポイントは以下です:
- 引き続き後発医薬品の新規承認時のGMP調査はPMDAが実施する(現状の都道府県調査から調査権者を変更する)(前回の提案のまま)
- 新医薬品の定期適合性調査(区分適合性調査)は、必要時にPMDAも調査ができるようにする(現状は都道府県が調査権者、前回提案ではPMDAに調査権限を移そうとした)
ということで、少し都道府県の役割を残す形となっています。合わせて、都道府県のGMP調査能力の維持、向上のために国の予算補助を含めて、手当する方向性が示されています。
個人的には第4回会議時の元提案が引き続き理想的ではありますが、GMP調査の見直しと同様、こちらも前回の議論を丁寧に手当した絶妙な提案になっているように見えます。
RMP(医薬品リスク管理計画)の運用案
RMP(医薬品リスク管理計画)については、法的位置づけの明確化がこれまで示されており、それであれば大きな運用変更はないかと考えていました。しかしながら、運用の見直し提案が今回示され、相応に運用の変更が想定されることが判明しました。
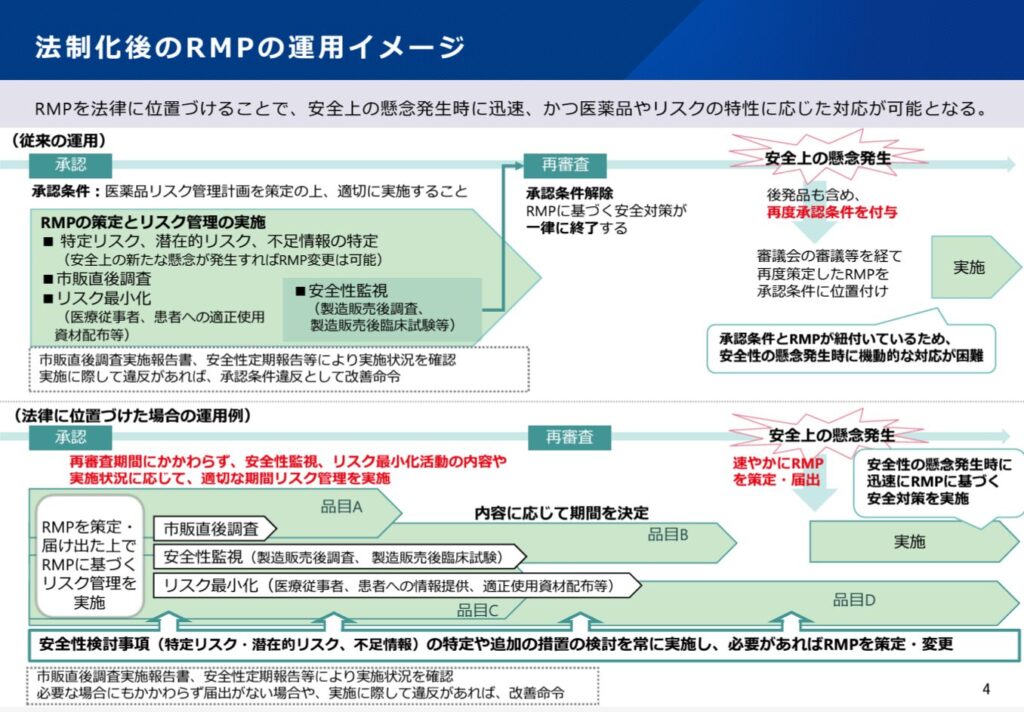
上記のイメージ図がきれいに現行及び法改正後の運用をまとめて示しています。
運用にあたって最も大きな変更点は、現行では承認条件としてRMPの策定、実施が求められますが、法改正後は(承認条件とはせず)必要な際の届出事項となることです。
これにより、医薬品承認時だけでなく、市販後に新たな安全性上の懸念が発生した場であっても、速やかにRMPの策定、実施が期待されることになります。
さらなる詳細は、実際に法改正対応が進んだ段階になろうかと思いますが、「届出が必要」と判断するのが誰であって、どのように引き金が引かれるのかが気になるポイントです。
その他
製造販売業の3役(総括製造販売責任者、品質保証責任者、安全管理責任者)に関して、薬機法の位置付けをどうするかの論点も詳細が示されました。
引き続き、総括製造販売責任者が全体を監督することは変わりませんが、総括同様、品質保証責任者及び安全管理責任者を薬機法上に規定し、順守事項を省令で規定する方向となります。
したがって、薬機法、薬機法施行規則に加えて、GQP省令やGVP省令も改正されることになります。
関連リンク
- 医薬品医療機器制度部会のページ:https://www.mhlw.go.jp/stf/shingi/shingi-kousei_430263.html
- 令和6年度第8回医薬品医療機器制度部会のページ(各種資料あり):https://www.mhlw.go.jp/stf/newpage_44832.html
- 2025年薬機法改正に向けた議論の開始:https://regulatory-j.com/act-revision-2024-1/


コメント