2024年4月18日の令和6年度第1回厚生科学審議会医薬品医療機器制度部会から、次期薬機法改正の議論が開始されています(関連記事)。
2024年10月3日に令和6年度第7回会議が開催となりました。今回は、これまでに本部会で議論されたいくつかのトピックについて、追加の議論が行われていますので、重要なポイントをまとめておきます。
なお、今回の会議で使用された資料のうち、下線が入っている部分が今回追加になっている内容となっています。
承認制度関連(小児、条件付き承認、中等度変更事項、その他)
第3回会議で議論された内容(関連記事)の追加議論がメインとなります。今回の会議資料はこちらになります。
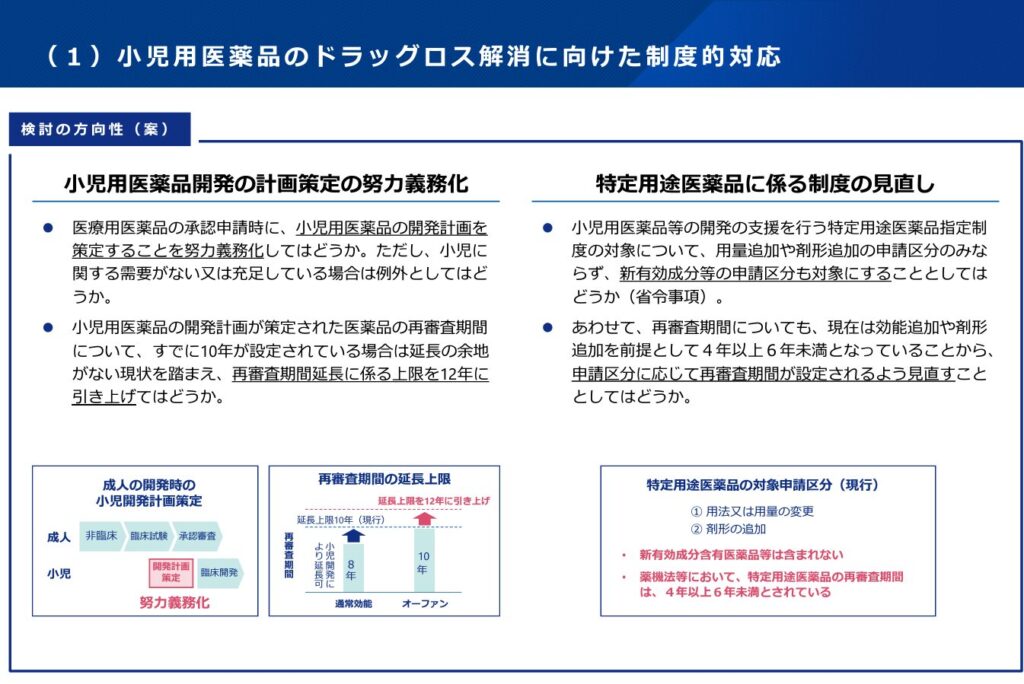
小児用医薬品の開発
まず、小児用医薬品の開発ですが、再審査期間の延長について、以下のスライドにあるように「12年まで」という具体的な数字が出てきました。現行の10年より2年延長ということで、数字自体はそうだろうなというものですが、これまでどのような場合でも再審査期間が10年だったところ、12年というさらなる延長期間の可能性が広がることは一定の意義があると考えています。(特許期間のほうが引き続き、独占販売期間に影響が大きいとしても。)
医薬品の条件付き承認
早期承認のために、「臨床的有効性が合理的に予測可能」という用語を持ってきました。再生医療等製品では「有効性が推定される」とされています。条件及び期限付き承認を受けた再生医療等製品の苦境もあり(関連記事)、用語選択に苦心の跡が伺えます。ただ、言葉遊び感もあり、(現行の条件付き承認と同様)引き続き、運用をどうするつもりかが大事な点になると考えます。合わせて、薬価、保険償還がどうなるかが一番の論点と考えています。この制度部会では保険の話は扱えませんが。

中等度変更事項
中等度変更事項については、しれっと大胆な提案が入っています。
中等度変更事項の処理は40日程度を想定するとのこと。こちらは、2024年9月から始まった中等度変更事項の試行的導入(関連記事)の流れに沿ったものとなっています、ここでは営業日とはなっていませんが。
一方で、軽微変更届の一部内容についての(事後)定期報告については、年1回は定期報告でよくある期限設定ですが、手数料を徴収するとの話になっています。
届出では手数料設定はできず、また、手数料を徴収しての報告というのも薬機法上は前例がないと記憶しています。例えば、安全性定期報告といったものがありますが、報告自体は無料です。こちらは安全対策拠出金の中から必要なリソース分の手当がされているという建付けになってはいますが。
今回の製造方法等の変更の報告については、行政として、報告内容の確認はしたい、そのためにはリソースが必要、ということでこのような仕組みの提案に至ったようです。

その他
リアルワールドデータ(RWD)について、「RWDの信頼性に関する基準の新設」といった話も出てきていますが、とりあえず運用で適切に対応していきますということが大事になってきそうです。
海外代替品等の迅速な導入の仕組みについて、包装に関連して「一定期間の外国語表示を認める特例を規定」する方向になりそうです。現在、表示については邦文記載が求められています。コロナ対応の際でさえ、この原則は維持されていました。したがって、背に腹は代えられないとはいえ、かなり大きな風穴を開けることになりそうです。
再生医療等製品
再生医療等製品では、規格外品の取扱いが制度部会及び今回の法改正での最も大きなポイントになってきますが、今回の会議では、規格外品の投与の場合であっても救済制度の対象となる旨が厚労省から整理して提示されました。

医療機器、体外診断用医薬品関連
会議資料はこちらになります。これまでの議論(関連記事)から大きな変更や目新しい内容はありませんでした。以下に医療機器プログラム(SaMD)の取扱いの資料は置いておきます。SaMDに関して、どのような目的、承認の範囲を設定するかによって、SaMDとなったり、ソフトウェアを備えた(通常の)医療機器となったりする場合があります。今回の提案では、そのような医療機器も優先的に対応するということが示されています。

関連リンク
- 医薬品医療機器制度部会のページ:https://www.mhlw.go.jp/stf/shingi/shingi-kousei_430263.html
- 令和6年度第7回医薬品医療機器制度部会のページ(各種資料あり):https://www.mhlw.go.jp/stf/newpage_44072.html
- 2025年薬機法改正に向けた議論の開始:https://regulatory-j.com/act-revision-2024-1/


コメント