新医薬品の承認申請について、英語での資料提出を試行的に可能とする旨を示した事務連絡「新医薬品の承認申請に際し承認申請書に添付すべき資料の提出について」が2024年9月6日に発出されました。(即日適用)
事務連絡という簡便な形かつ1ページだけの短い通達になりますが、大きな変化の第一歩となりますので情報を整理しておきます。
事務連絡発出の背景
事務連絡では、今回の対応は「ドラッグ・ラグ・ロスの解消を目的として外国の事業者でも日本国内での承認申請を容易とするため」とされています。
PMDAの相談・審査に対する英語対応については、「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議」の中間まとめでも言及されており(概要、本文)、工程表において、以下のように2025年度からの英語資料の受け入れ試行が明記されていました。
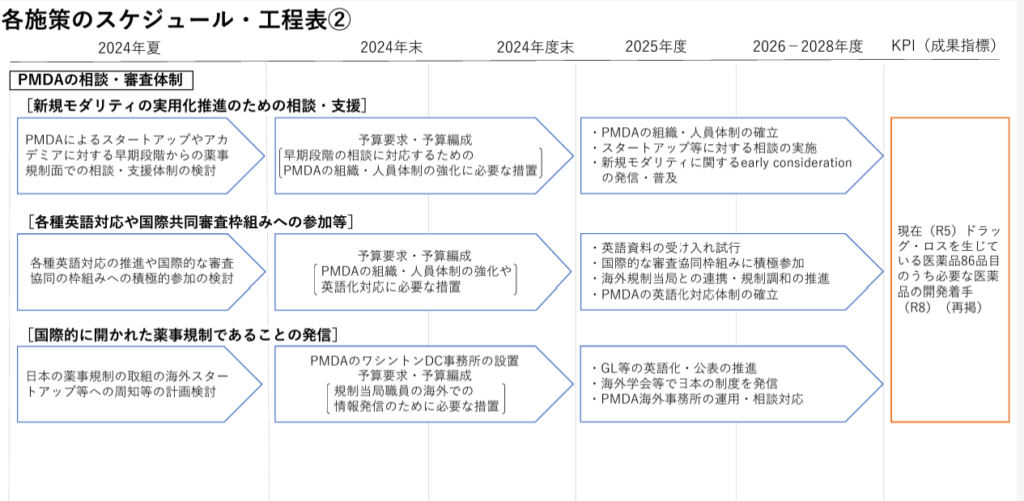
この想定で、2025年度の厚労省予算要求でも該当の施策があります。「創薬力強化のための早期薬事相談・支援事業」がそれであり、国が認定したシーズに対して、PMDA相談を英語で実施するということで、翻訳費用等が計上されています。(2025年度予算要求の情報まとめはこちら)
一方で、厚生労働省国際保健ビジョンでは、別途、「将来のエコシステムの拡大を念頭に、日本での承認申請資料の全面的な英語化を進め」という記述が入っていました。
これらの状況を踏まえると、国際保健ビジョン作成の過程で英語対応のさらなる前倒し対応が(トップダウンで)議論されたのではないかと推察されます。
英語での資料提出の条件
今回の事務連絡に基づく、英語での資料提出については、試行的ということで以下の条件があります。
- 「新医薬品」の承認申請であること
- 「申請時」において、承認申請書、添付文書を含むCTDの内容すべてに関して英語表記を可能とすること
- 「日本法人や日本事務所を有しない外国企業」の承認申請であること
1点目の「新医薬品」が対象ということで、すべての医薬品(、医療機器、再生医療等製品)が対象になるわけではありません。新医薬品とはPMDAのホームページでは以下のように示されています:
「新医薬品」とは、医薬品医療機器法第十四条の四に定められる既に承認を与えられている医薬品と有効成分、分量、用法、用量、効能、効果等が明らかに異なる医薬品であり、主に、新有効成分含有医薬品、新医療用配合剤、新投与経路医薬品、新効能医薬品、新剤型医薬品、新用量医薬品などです。
2点目は、あくまで「申請時」にすべての書類が英語表記であってもよい、というように読めます。すなわち、どこかのタイミング(承認)までに、日本語の資料が求められる可能性が排除されていません。
3点目は、分かりやすい条件かと思いますが、英語で提出予定があれば、PMDA審査マネジメント部にあらかじめ相談すること、とも指定されています。この条件に該当するような外国企業と、PMDA審査マネジメント部が適切かつ適時にコミュニケーションできるのかは1つのハードルになるのではないかと考えます。
その他
まず、上記2点目について、申請時に英語表記が可能とまでしか示されれていないことは、薬機法施行規則の規定が関連していると考えられます。以下、施行規則第283条の条文です:
(邦文記載)
第二百八十三条 厚生労働大臣、地方厚生局長、都道府県知事、保健所を設置する市の市長若しくは特別区の区長若しくは機構又は登録認証機関に提出する申請書、届書、報告書その他の書類は、邦文で記載されていなければならない。ただし、特別の事情により邦文をもつて記載することができない書類であつて、その翻訳文が添付されているものについては、この限りでない。
この施行規則の規定により、少なくとも承認申請書は、邦文記載(又は翻訳)が求められています。事務連絡で施行規則の内容を変えることはできませんので、この条文は引き続き適用されることになります。
また、CTDに添付文書(案)の情報が含まれていますが、最終的に日本で医薬品が流通する際には、添付文書は邦文記載が必要となります(施行規則第218条)。
したがって、これらの施行規則の規定を順守しながら、事務連絡のような対応を進めようとした結果、今回のような表現となっていると読めます。
次に、「当分の間」の試行であり、その後、拡大の可能性を検討する旨が示されています。この当分の間がどの程度を想定されているのかはこの事務連絡からは全く読み取れませんでした。
一方で、本気で拡大していくつもりがあれば、上記施行規則の条項を手当する可能性が考えられます。その意味で、現在、薬機法改正の議論が行われており、今秋又は来年(2025年)にも薬機法改正のための法案が提出されることが見込まれていることを踏まえると、法改正に続く、関連政令、省令(施行規則を含む)の改正において、この点が入ってくるかがまずはの試金石になってきます。


コメント