2025年6月30日付けで「要指導医薬品及び一般用医薬品の承認の予見性向上等に向けた総審査期間の考え方について」との通知が厚労省から発出されました。
いわゆるOTC薬の総審査期間についての考え方を示したものになります。総審査期間とは、当局(PMDA及び厚労省)が審査に要した時間と申請者(企業等)が照会対応等で要した時間を合算したものになります。
この通知は、PMDAの2025年度の事業計画(業績の指標)において、OTC薬の審査期間を50%タイル値で12か月を達成する、ということが設定されたことを受けての対応になります。
医療用医薬品の新医薬品については、2014年10月6日付けで「新医薬品の承認の予見性向上等に向けた承認申請の取扱い及び総審査期間の考え方について」との通知がすでに出ています。
ここでは、これらの通知のポイントを整理しておきます。なお、新医薬品の審査の流れ(標準的な審査期間を含む)はこちらにまとめています。
OTC薬の総審査期間の考え方
通知の意図は、申請者側が照会対応等に一定以上時間を要する場合、PMDAの業績指標の母数に含めない、ということです。したがって、そのような審査事例は、除外された上でPMDAの実績を示します、ということになります。
具体的には、以下のように、審査の各タイミングでの申請者側の持ち時間が設定されています。
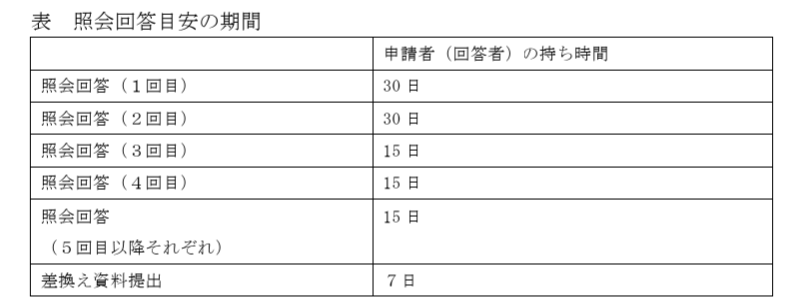
通常重い対応となる、早い段階での照会対応で30日(営業日ではなく、暦日)となっています。
各段階で申請者が要した時間を合算し、その差し引きが+30日以上となった場合は、その品目はPMDAの実績確認から除外されることになります。
新医薬品の総審査期間の考え方
新医薬品の場合は「申請者側の対応により著しく総審査期間が経過する場合、文書により連絡の上、それぞれ次の期間を総審査期間に含めないことができるものとする」とされています。
OTC薬の場合のようにPMDAの実績確認から該当品目を除外するのではなく、該当品目は実績に含まれるものの、総審査期間の計算から該当期間を除外するという対応となっています。
また、この通知の中で著しく総審査期間が経過する場合とはどのような場合かが示されています。
- 申請された内容では有効性・安全性について確認できず、再試験又は追加試験の実施等を求める照会事項があり、申請者の回答作成に12ヶ月以上を要すると機構の担当審査部が判断した場合
- 複数の再試験又は追加試験の実施を求める照会事項があり、試験を複数実施した場合、申請者の回答作成に12ヶ月以上を要すると機構の担当審査部が判断した場合
- 審査において、主要照会事項に対する回答期間が12ヶ月以上累積した場合
- GMP調査及びGCP調査に対する照会の回答において、優先審査の場合6ヶ月以上、通常品目の場合7ヶ月以上を要した場合
- 申請者側の理由により、GMP調査の実施に、承認申請日に標準的事務処理期間を加算した日から6ヶ月を遡った日を起点として12ヶ月以上を要した場合
- 申請者側の理由により、GCP調査等に必要な資料の提出が、資料提出依頼日から12ヶ月以上を要した場合
すなわち、審査やGMP/GCP調査の対応で、申請者側が12か月以上時間を要する、または、要することが見込まれる場合になります。
そのような場合には、総審査期間から申請者が対応に要した期間を除くということになります。
なお、新医薬品の場合の通知では、総審査期間の考え方の他、審査予定事前面談を求めることや取り下げ対応に関する事項も記載されています。
所感
OTC薬、新医薬品のいずれの場合も、申請者側の都合で審査が長引く場合に手当がされることになります。したがって、PMDAが算出する実績は、「実際の」審査期間を示すものとなっていないことに留意が必要です。
PMDAからすると、申請者の都合で自身の実績に負の影響が出ることは避けたいのでしょう。一方で、そもそも照会の質が妥当であったかといった点のように、申請者側の都合が本当にそうだったのかは、ここでの対応では見えてこない可能性があります。


コメント