2024年11月7日付けで「感染症対策上の必要性の高い医薬品の承認申請について」という医薬品審査管理課長(及び感染対策症課長の連名)通知が発出されました。
本通知は、重点感染症などの感染症対策上の必要性が高い医薬品について、健康・生活衛生局感染症対策部が要望を作成し、医薬局がそれを受けて決定することで、承認申請に際して特例的な対応がなされるということを示した通知になります。
通知の内容
COVID-19発生時のような緊急時では特例承認や緊急承認が利用可能ですが、今回の通知では、現時点で発生が極めてまれ又は発生していない感染症に対する医薬品を早期に承認しておくために設定された仕組みになります。
該当する医薬品としては以下のすべての条件を満たす必要があります。
- 重点感染症(及びその他の対策が必要な感染症)を適応とする
- 国内で発生が極めて少ない又は発生していないので、国内で有効性に関する比較試験の実施が困難
- 米国等で承認等が得られている
- 米国等での承認申請資料(CTDの2~5部)の提出が可能
上記を満たす医薬品については、米国等での承認申請資料をベースに、追加の試験結果を求められることがない場合もありつつ、特例的(優先的)に承認審査を行う旨が示されています。
冒頭に記載しましたが、対象品目の特定は、厚労省主体で進められることになります。
この通知を受けた対応の流れは以下のようなイメージになります。(こちらの資料より)
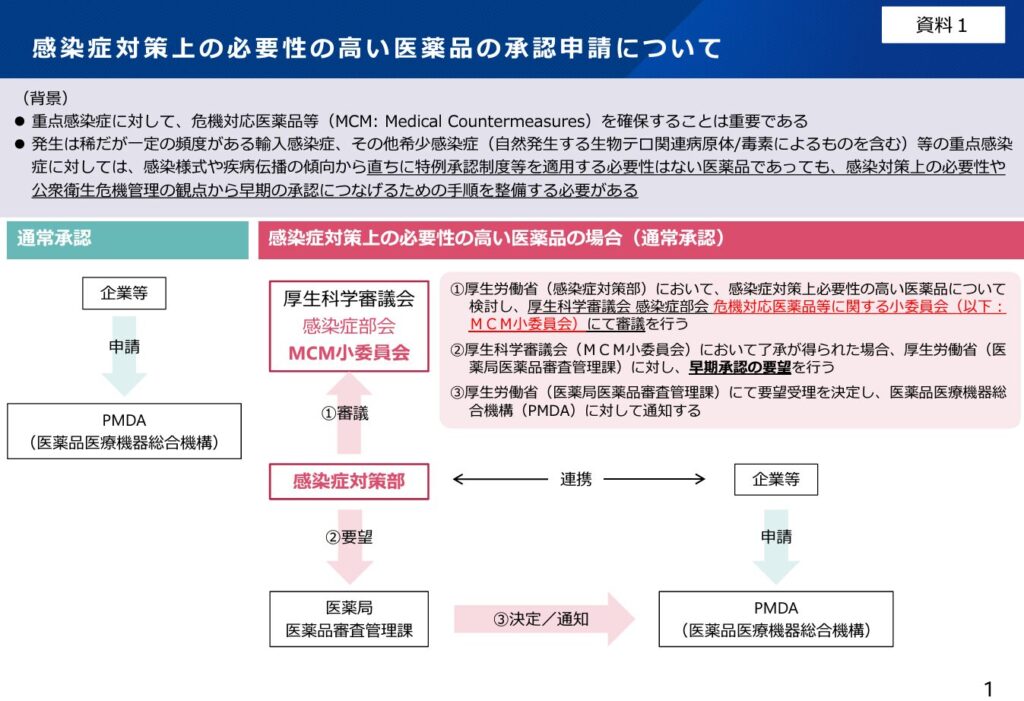
通知発出の背景
今回の通知発出に向けて、厚労省の厚生科学審議会の「危機対応医薬品等に関する小委員会」で議論が行われました。(2024年9月30日開催分)
上記の対応のイメージ図もそこで示されたものですが、厚労省の感染症対策部が感染症部会の審議結果を受けて、医薬局に要望、医薬局が通知の適用を判断し、PMDAに連絡する仕組みとなっています。
そもそもは、2022年に健康局が主催する検討会として「感染症危機対応医薬品等の利用可能性確保に関する検討会」が設置、実施されていました。
その中で、重点感染症の考え方及び暫定リストを整理し、2022年3月31日の感染症部会にて了承されました。こちらが報告書になります。また、報告書の概要をまとめたスライドは以下になっています。
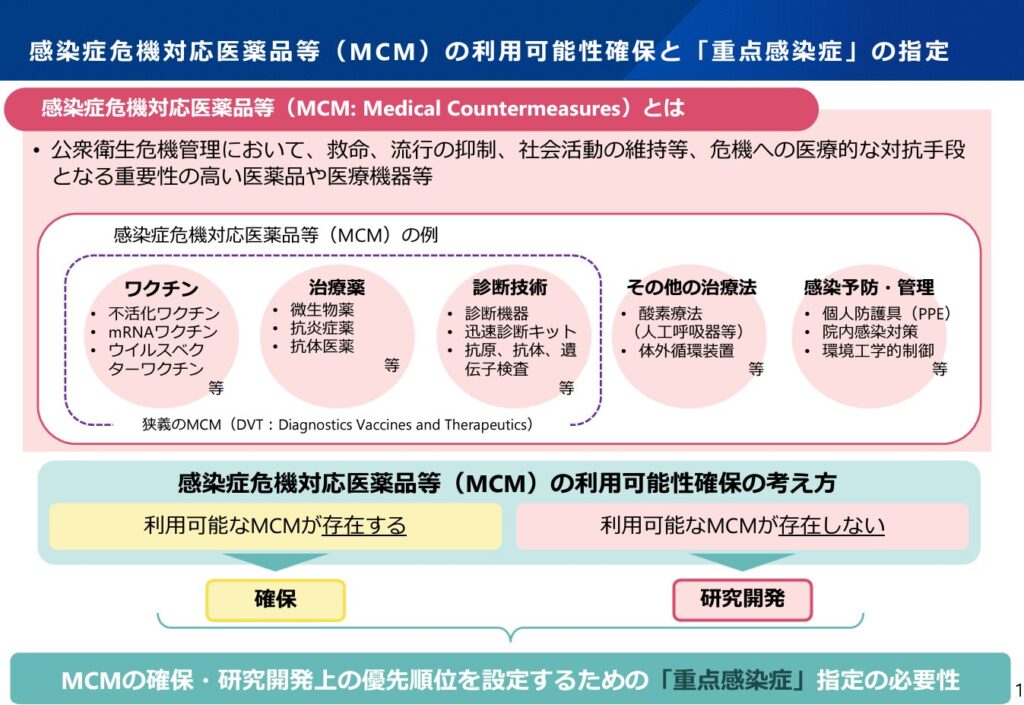
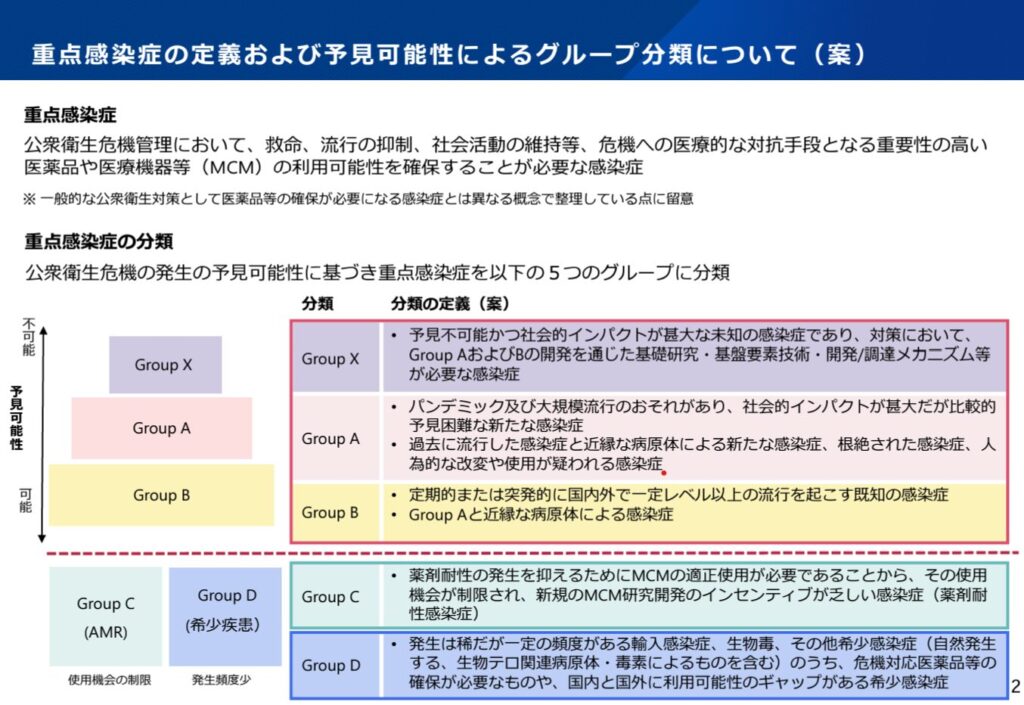

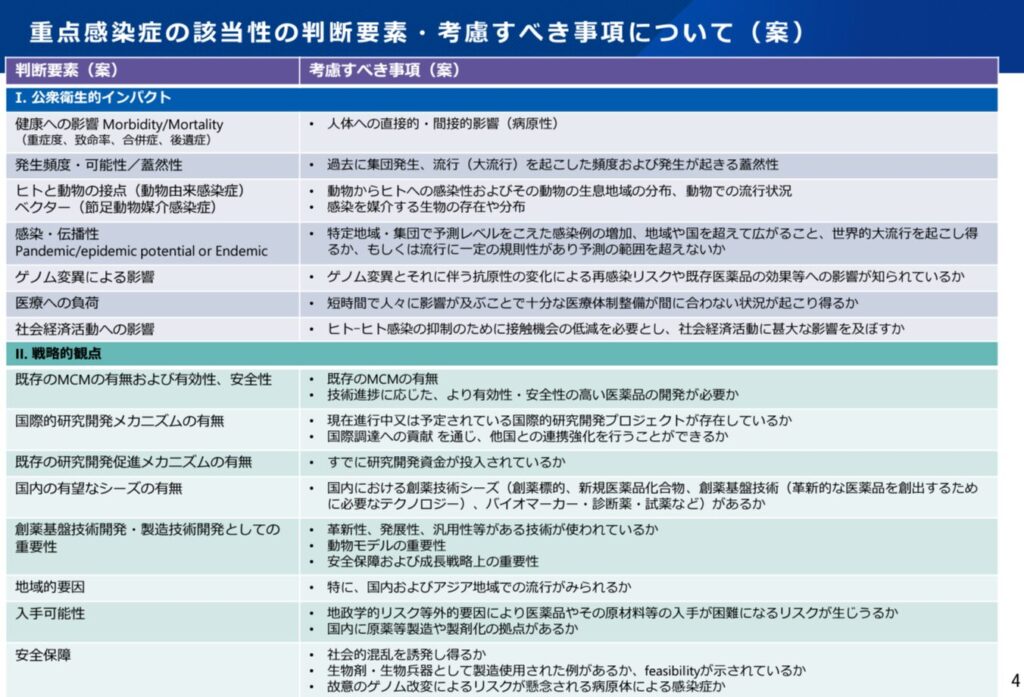
この2022年の整理を踏まえて、AMEDの開発予算措置等、重点感染症に対する政府対策が行われてきました。
その一環として、今回の通知発出に至ったことになります。
また、この通知の対応を議論した2024年9月30日の会議では、今後、重点感染症のリストを見直すことも議論されています。


コメント