2024年10月に米国FDAがAccelerating Rare disease Cures (ARC) Programの2年目の報告書を公表しましたので、中身をみておきます。
このACRプログラムは、2022年にCDERが立ち上げたもので、FDA部門横断的に希少疾病の開発に資する各種活動を行っていきます、というものになります。
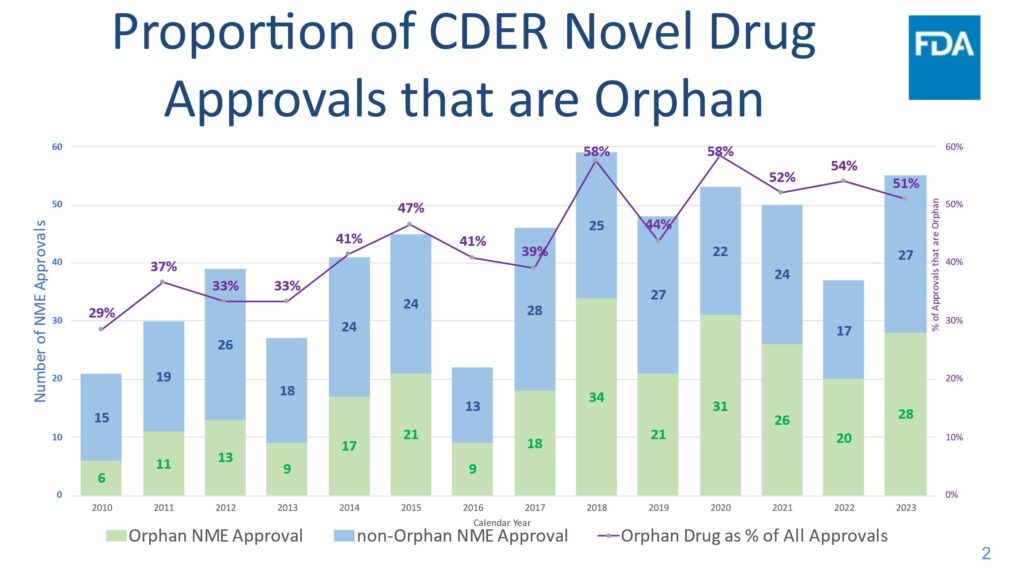
なお、希少疾病用医薬品の米国承認(新有効成分)は、近年、50%を超えてきています。(こちらより)
今回のARCプログラムの2年目の報告書のうち、患者対応を含む外部発信及び教育に加えて、Rare Disease Endpoint Advancement (RDEA) Pilot Program、Support for clinical Trials Advancing Rare disease Therapeutics (START) Pilot Programを以下で整理しておきます。その他、いろいろなワークショップや検討をしている旨も記載していますが、いずれも継続した議論/対応が続く内容であろうと考えいます。
外部発信及び教育
今回の報告書では、医薬品開発に患者の声をどのように取り入れていくか議論すべく、患者団体を巻き込んでのワークショップを開催してきた旨が言及されています。
また、Learning and Education to Advance and Empower Rare Disease Drug Developers (LEADER 3D)の活動を通して、教育用資材を作成、公表した旨がハイライトされています。
その他、ニュースレターの発行、ウェブサイトの充実といった対応を進めてきた旨が報告されています。
Rare Disease Endpoint Advancement (RDEA) Pilot Program
こちらは、CDERに加えてCBERも参加するプログラムになります。開発(治験前、治験中)段階の品目を持つ企業等を対象として、希少疾病に関するエンドポイントの開発について、FDAが協業、支援するという枠組みです。合わせて、そのような新規のエンドポイントに対するFDAの理解促進も期待されています。
報告書では、本プログラムのウェブサイトにおいて、手続き的な部分の内容を充実させたことが示されています。2024年10月時点で、どのような品目、エンドポイント、企業が本プログラムに採択されたかは示されていません。
Support for clinical Trials Advancing Rare disease Therapeutics (START) Pilot Program
こちらは、希少疾病の品目開発にあたって、具体的な課題等をFDAと密に協議して解決を目指すプログラムになります。
2024年1月~3月の募集に対して、30件の申し込みがあり、うち13件をFDAが検討し、最終的に神経変性疾患に関連した以下の3つのプログラムがパイロットの対象として採択されました。
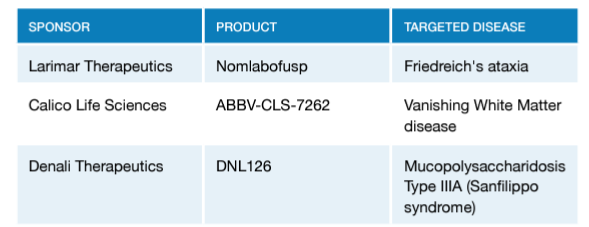
なお、STARTパイロットプログラムのページでは、CBERの採択品目も掲載されています。
関連リンク
- Accelerating Rare disease Cures (ARC) Program:https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/accelerating-rare-disease-cures-arc-program
- Learning and Education to Advance and Empower Rare Disease Drug Developers (LEADER 3D):https://www.fda.gov/about-fda/accelerating-rare-disease-cures-arc-program/learning-and-education-advance-and-empower-rare-disease-drug-developers-leader-3d
- Rare Disease Endpoint Advancement Pilot Program:https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/accelerating-rare-disease-cures-arc-program
- Support for clinical Trials Advancing Rare disease Therapeutics (START) Pilot Program:https://www.fda.gov/science-research/clinical-trials-and-human-subject-protection/support-clinical-trials-advancing-rare-disease-therapeutics-start-pilot-program


コメント