2024年9月27日付けで「中等度変更事項に係る変更手続の導入の試行について」(医薬品審査管理課長通知)と「中等度変更事項に係る変更手続の導入の試行に関する質疑応答集(Q&A)について」(医薬品審査管理課事務連絡)が発出されました。
薬機法の制度上、医薬品の製造方法等の変更にあたっては、承認事項の一部変更に係る申請(一変申請)と軽微な変更に係る届出(軽微変更届)の手続きがあります。
「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」の報告書でも言及がありましたが、欧米の制度と比較した場合に中リスクの変更に関して、迅速に処理されない点が指摘されていました。(関連記事)
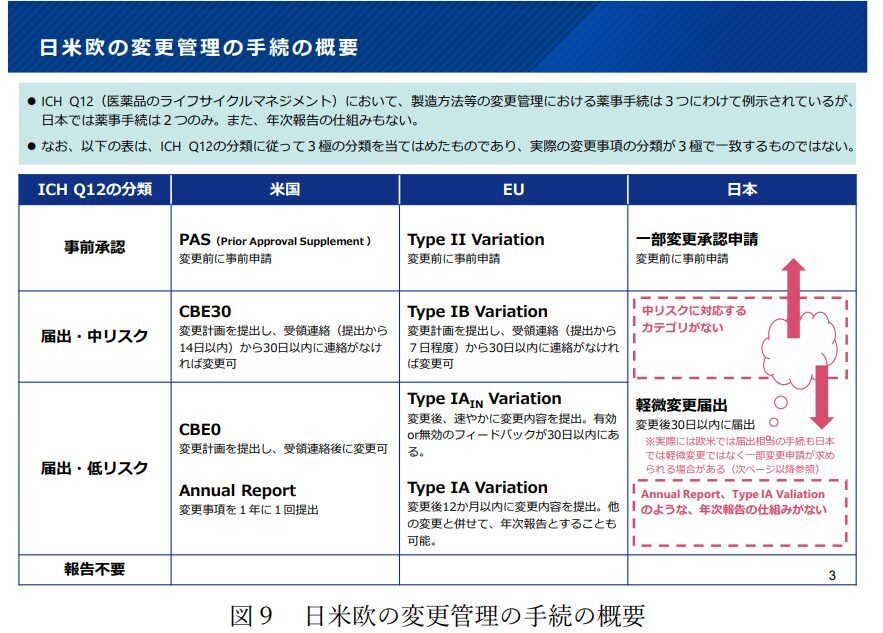
今回、この通知の発出をもって、製造方法等の中等度変更の迅速な処理を試行的に始めることとなりましたので、通知のポイントを整理しておきます。試行的かつ任意の仕組みとなりますので、これまで通り、中等度変更を活用せずに、通常の一変申請で対応することも可能です。
まず、今回の中等度変更に関する対応は、(軽微変更届ではなく)一変申請の一類型として行われることです。したがって、製造方法等の変更を導入するより前に申請手続きを行う必要があります。
次に、中等度変更事項については、これから承認申請を行うような品目の場合、あらかじめ、中等度変更事項である旨を明示する必要があります。すでに承認されている医薬品の場合、医薬品手続相談をあらかじめ実施して、中等度変更での対応でよいかPMDAと合意しなければなりません(相談が必須です)。
なお、医薬品手続相談の手数料は150,900円です(2024年度)。また、実際のミーティングまで3か月程度の時間を要します(PMDAウェブサイトより)。
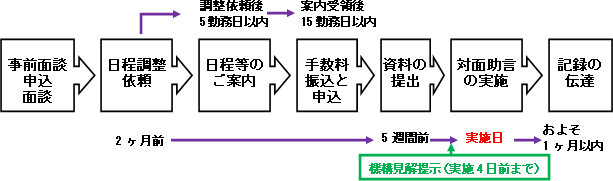
中等度変更については、「中等度変更迅速審査」として、申請から承認まで40営業日の処理が目標とされています。通常の一変申請では総審査期間12か月が目標となりますので、中等度変更迅速審査では10か月程度早く処理されることが想定されます(ただし、上述のように、医薬品手続き相談に3か月はかかります)。
この審査期間(事務処理期間)を営業日で規定するのは、薬機法運用上、初めての試みではないかと思います。また、17時をすぎてのPMDAからの照会事項、申請者からの回答提出が、翌営業日として処理されるということもこれまでにないルールになります。
中等度変更の申請から承認までの流れは以下となっています。
- 申請受理後10営業日以内に中等度変更事項としての受付の可否を確認
- PMDAから照会事項がある場合は、申請受理後40営業日以内に承認申請者に発出(すなわち、この場合、申請から承認が40営業日とはならない)
- 承認申請者は、照会事項の送付日から30営業日以内にPMDAに回答を提出(回答提出が間に合わない場合、通常の一変申請対応に切り替え)
- 回答の提出日から20営業日以内に承認の可否を決定
- (更に審査に時間を要する場合には、通常の一部変更申請に切り替え)
この流れを踏まえると、医薬品手続き相談3か月、申請から照会発出まで2か月、照会回答に1.5か月、承認決定までに1か月と、合計7.5か月となります。迅速な審査を達成するためには、PMDAからの照会発出とならないよう、医薬品手続き相談でどの程度しっかり議論ができるかもポイントになりそうです。
並行して、適合性書面調査の対応が発生することも明示されています。GMP適合性調査の対象となるような変更は、現時点では、この試行の対象外とされています。
その他、試行対象とできる申請の件数には制限があり「PMDA全体で月15件程度、各審査部で月1~2件程度を目安として先着順」とされています。
なお、医薬品医療機器制度部会でも中等度変更に関する議論が行われており(関連記事)、今回の試行運用と並行して、本格導入に向けて、法改正も視野に議論、対応が進んでいくことが見込まれます。


コメント