2024年11月8日付けで「医療上の必要性の高い未承認薬・適応外薬の開発要請に対する企業見解の提出に伴う手続の迅速化について」という通知が厚労省から発出されました。
こちらは未承認薬検討会議において、医療ニーズが確認され、企業に開発要請がなされた場合であって、企業が公知申請を目指す場合に対応を迅速に進めることを意図した通知となっています。
未承認薬検討会対象品目であって、企業が公知申請が妥当と考える品目について、PMDAとの相談について、これまで具体的な手続きは示されていませんでした。
今回の通知によって、企業は、公知申請が妥当と考える場合は、開発要請受領後1か月を目途に、PMDAに対して事前面談(無料)を申し込むことが求められます。
事前面談実施後、必要に応じて有料の「医薬品優先審査品目該当性相談」に進むことになります。
この手続きの明確化により、企業が開発要請に対して迅速に対応することが期待されます。
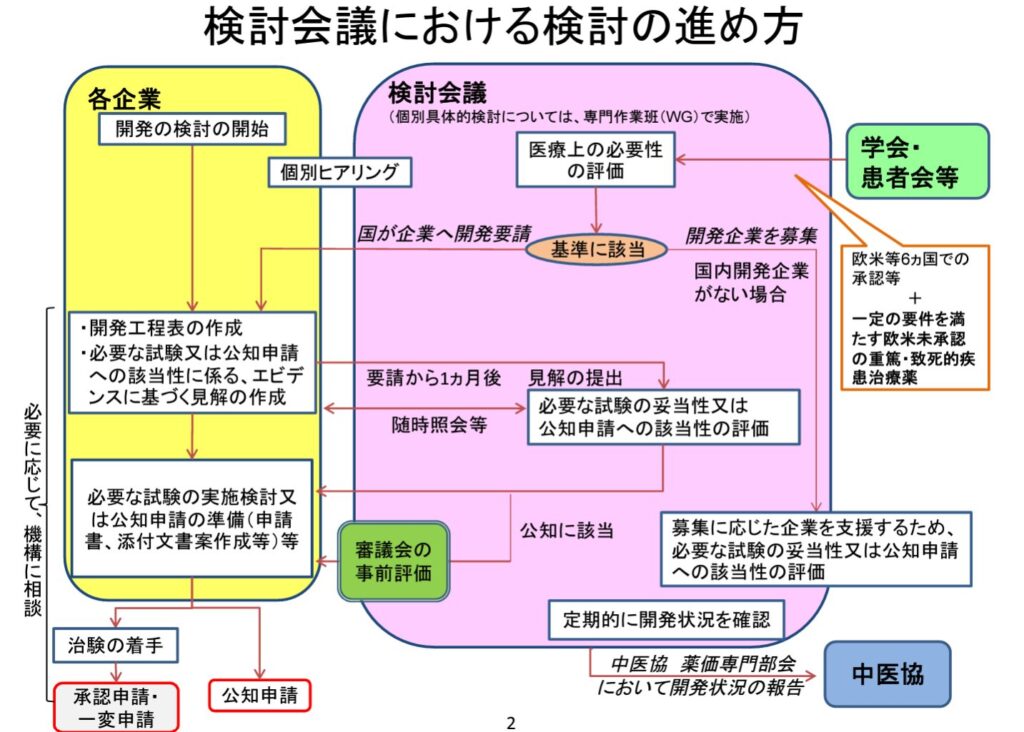
なお、未承認薬検討会での品目の検討の流れは以下のようになっています(未承認薬検討会資料より)。
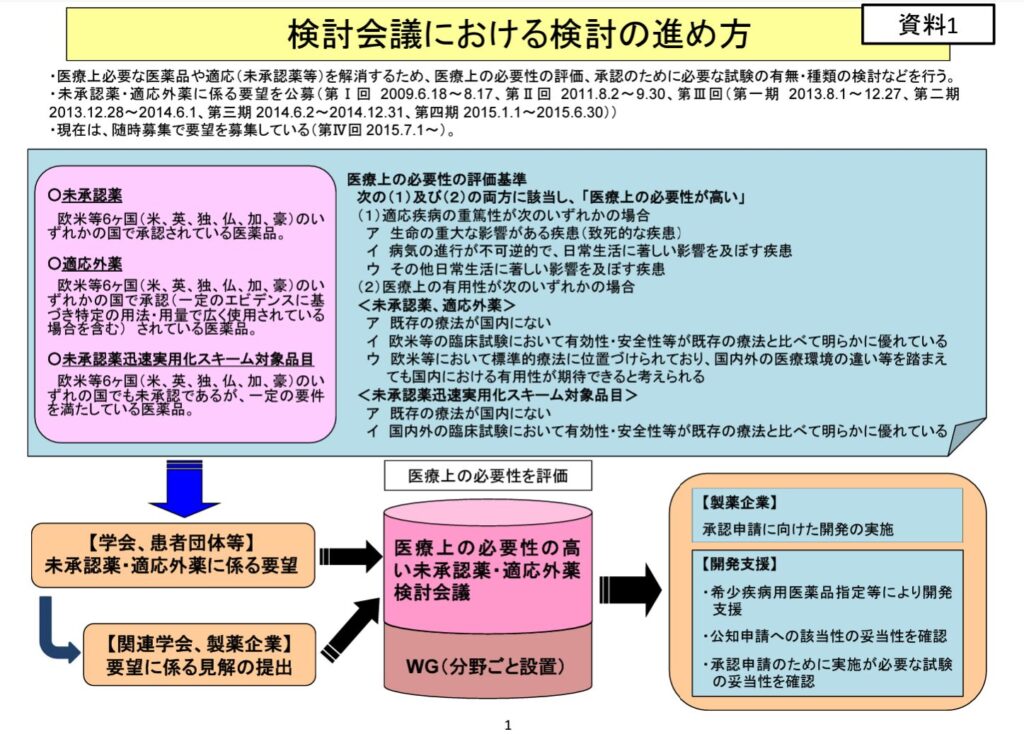
未承認薬、適応外使用薬について、学会や患者団体からの要望を受けて、未承認薬検討会におけるワーキンググループにて医療上の必要性を検討します。
そして、医療上に必要性があり、となった場合、厚労省から企業に対して開発要請、又は、開発の募集が実施されます。
企業は、要請後1か月で見解を未承認薬検討会議に提出することで、当該会議にて追加の試験の必要性や公知申請の妥当性が議論されることになります。この際に、企業はPMDAと並行して適宜相談となっていました。今回の通知により、公知申請を想定する場合、企業はまずPMDAと相談しておくように、ということになりました。


コメント