ドラッグ・ラグ/ドラッグ・ロスの解消や創薬力強化を目指して薬事規制関連の議論を進めるために、「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」が2023年5月~2024年3月に開催されてきました。
この検討会で議論があり、通知化に向けて対応中となっている事項に「迅速な承認制度のあり方」の話があります。
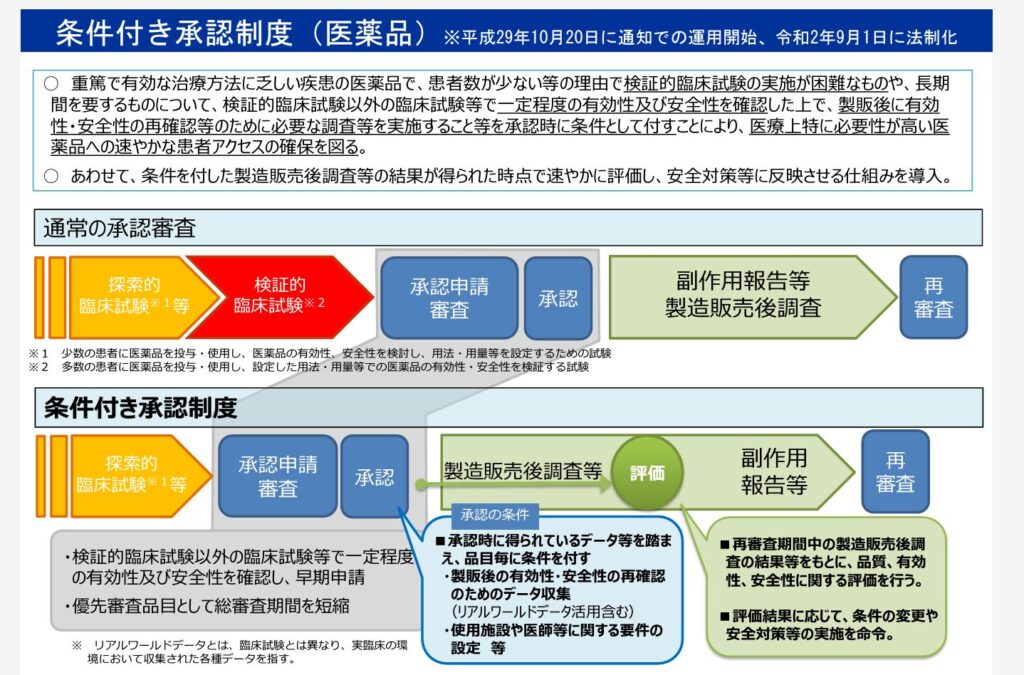
医薬品の条件付き承認とは
2017年10月から通知での運用が開始となり、2020年9月に法的位置づけが明確化された承認制度です。
2022年6月22日の医薬品等行政評価・監視委員会で提示されたこちらの資料において、制度の概要と実績が示されています。条件付き承認制度は、
重篤な疾患に対して、
既存の治療法等より優れた有効性及び安全性が期待でき、
検証的試験の実施が困難であって(時間を要することも含む)、
検証的臨床試験以外の臨床成績から一定の有効性及び安全性が確認できる、
ような場合に、検証的臨床試験の結果を待たずに早期に承認する一方で、条件として検証的臨床試験等の実施を求める制度になります。
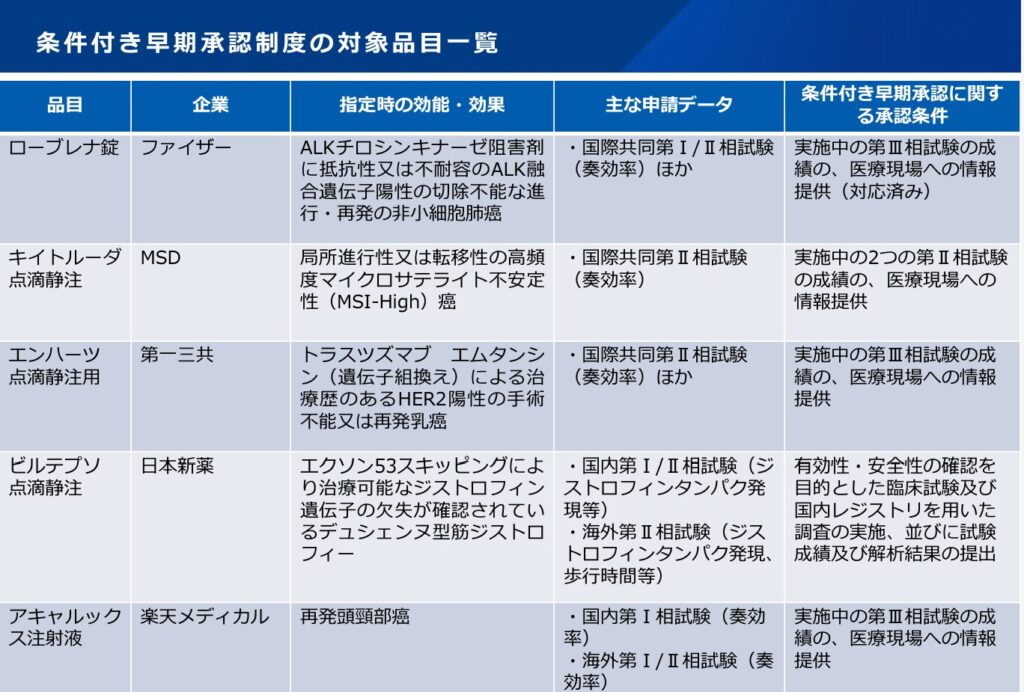
当時の資料で示されている実績は以下ですが、すべて法制化前に承認された品目になります。また、5件の承認のうち、4件が抗がん剤です。
条件付き承認制度により、重篤な疾患において、より早期の医薬品アクセスを可能とすることが想定されています。
検討会を踏まえての対応方針
検討会での議論を踏まえて、報告書において以下のような対応方針が示されました。
まずはは、「検証的臨床試験の実施が困難又は相当の時間を要する」場合として、日本人の追加データが必要となる場合等も含まれることを明確化することが想定されています。この点は、まずは通知対応でも手当ができそうです。
また、承認条件として実施する製造販売後の試験については、異なる治療ラインや、異なる疾患の進行段階であっても認められる場合があることも明確化されそうです。こちらも通知での手当で対応可能です。
さらに、条件付き承認のあり方については、法改正の要否を含めて、今後検討していくこととされました。こちらは、2025年薬機法改正に向けた議論の中で取り扱われることになるでしょう。
その他、条件付き承認の検討は、PMDAの体制強化(予算措置)の口実にも使おうとされています。さらに、予算措置の観点では、審査の過程でアカデミアや患者団体の意見を反映する仕組みについての研究費を要求していくようです。
医薬品の条件付き承認がもっと活用されるためには
上記対応方針のうち、通知で手当てする内容では日本での条件付き承認がより活用される状況にはならないと考えます。
日本では、通常の承認でも製造販売後の調査が条件として安易に設定される中、あえて条件付き承認とするような品目、適応は生じにくいためです。通常の開発であれば、検証的臨床試験の規模や要件にもよりますが、ある程度の臨床データが得られた時点で、通常の承認を目指した承認申請を選ぶことなるでしょう。
そこで、条件付き承認がより活用されることを目指すためのアイデアとしては、「医療上の必要性の高い未承認薬・適応外薬検討会議」(未承認薬等検討会議)で医療上の必要性があるとされた要望であって、開発要請をするような品目を対象とすることが挙げられます。
未承認薬等検討会で要望が出て開発要請が必要な品目・適応であるということは、医療上の必要性はすでにある中で、一定程度の外国臨床データがあり、日本以外での承認等がある状況が想定されます。そのような品目・適応に対して、日本の患者さんにも早期にアクセスできるようにするためには、今あるデータを最大限活用をする、ただし、製造販売後のデータを収集する、という施策に一定の合理性はあると考えます。また、この場合、開発要請を受けた企業の負担も考慮した対応が可能となるのではないでしょうか。
再度になりますが、通常承認でも製造販売後調査等の条件が安易に付される日本にあって、そもそも条件付き承認が必要か、という議論がまずはなされることを期待しますが、せっかくある条件付き承認制度を活用しようということであれば、未承認薬等検討会の仕組みと紐付けることが一考かもしれません。
関連リンク
- 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会:https://www.mhlw.go.jp/stf/shingi/other-iyaku_128701_00006.html
- 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書:https://www.mhlw.go.jp/content/11121000/001248959.pdf
- 医薬品の条件付き承認の取扱いについて(2020年8月31日付け、医薬品審査管理課長通知):https://www.mhlw.go.jp/web/t_doc?dataId=00tc5290&dataType=1&pageNo=1
- 医療上の必要性の高い未承認薬・適応外薬検討会議:https://www.mhlw.go.jp/stf/shingi/other-iyaku_128701.html


コメント