2024年9月6日から、新医薬品の承認申請における英語での資料提出が試行的に実施されていますが(関連記事)、あらためて、薬機法下での「新医薬品」とは何かを整理しておきます。
「新医薬品」の定義
PMDAのホームページでは、以下のように説明されています。
”「新医薬品」とは、医薬品医療機器法第十四条の四に定められる既に承認を与えられている医薬品と有効成分、分量、用法、用量、効能、効果等が明らかに異なる医薬品であり、主に、新有効成分含有医薬品、新医療用配合剤、新投与経路医薬品、新効能医薬品、新剤型医薬品、新用量医薬品などです。”
PMDAの説明にあるように、既承認の医薬品と「明らかに異なる」医薬品が「新医薬品」に該当します。
有効成分が異なる医薬品が「新医薬品」と呼ばれることはイメージしやすいかと思います。
一方で、例えば、新たな適応追加、新たな用法・用量の追加といった場合であっても「新医薬品」と呼ばれる可能性があります。
なお、法的には、薬機法第14条の4第1項第1号に以下のように「新医薬品」が規定されています。
”既に第十四条の承認又は第十九条の二の承認(同条第五項において準用する第十四条の二の二第一項の規定により条件及び期限を付したものを除く。以下この項において同じ。)を与えられている医薬品と有効成分、分量、用法、用量、効能、効果等が明らかに異なる医薬品として厚生労働大臣がその承認の際指示したもの(以下「新医薬品」という。)”
薬機法第14条の4は、再審査期間の設定に関する規定になります。審査において、(厚生労働大臣の指示により)新たな再審査期間が設定される品目が「新医薬品」に該当するとも言えます。
「新医薬品」の標準的な審査の流れ
「新医薬品」の説明と同様に、PMDAのホームページに掲載されています(こちら)。
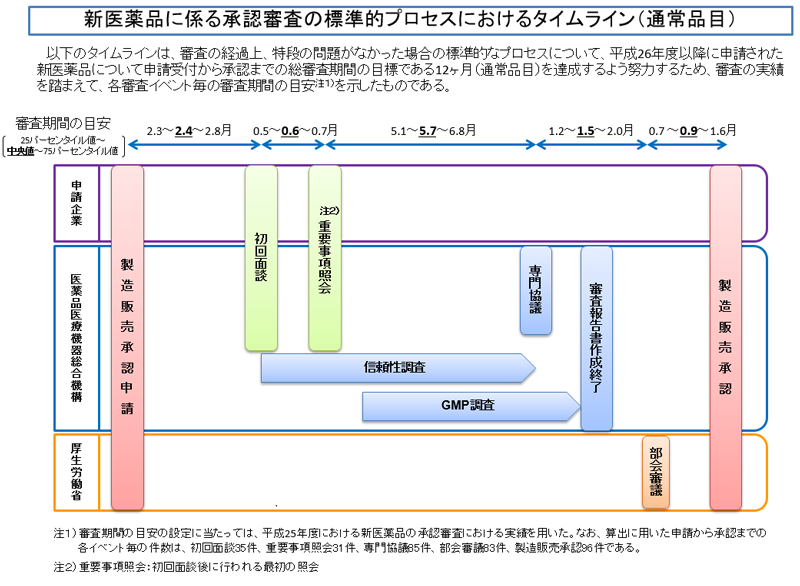
上記は、通常審査品目の場合です。通常審査品目では目標総審査期間(PMDA側の審査期間+申請者側が照会対応等で要する期間)が12か月間になります。
以下は、優先審査品目の場合です。優先審査品目の目標総審査期間は9か月間になります。希少疾病医薬品の指定を受けた品目等が優先審査に該当します。
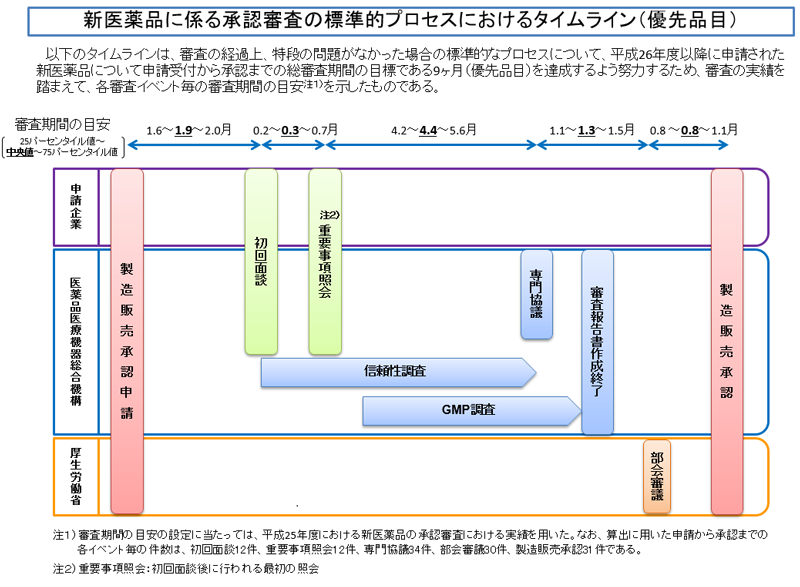
通常審査、優先審査のいずれの場合でも、承認申請から2か月後程度を目安にPMDAとの最初の面談(初回面談)及びその後の最初の照会事項が発出されます。初回面談はなしとなることもあり、その場合、最初の照会事項は少し早めの発出となります。
また、部会審議から承認までの期間は、通常審査、優先審査とも実質取扱いは変わりません。部会審議以降の対応は、PMDAではなく、厚労省での対応であり、一律に処理されていきます。
通常審査の品目では、優先審査の品目と比較して、初回照会事項発出から専門協議までの期間にゆとりがあります。信頼性調査は専門協議前までに終わらせること、GMP調査は審査報告書作成/部会審議前に終わらせること、がターゲットになります。したがって、これらの調査も通常審査品目で少しゆとりができることになります。
個々の品目において、各イベント(初回面談、重要事項照会、専門協議、部会審議、信頼性調査)がどの時期に発生する見込みかは、承認申請前に「審査予定事前面談」(無料)を実施することでPMDAから具体的に伝達されます。(審査予定事前面談に関する通知はこちら)
審査予定事前面談は、承認申請の3~1か月前に実施することが期待されています。(PMDAの新医薬品承認審査予定事前面談実施要綱より)
なお、承認申請に必要な資料については、「医薬品の承認申請について」(2014年11月21日付け、医薬局長)という通知に示されています。ここでも、「新医薬品」の規定が示されています。
関連リンク
- PMDAのホームページ、新医薬品(医療用医薬品):https://www.pmda.go.jp/review-services/drug-reviews/about-reviews/p-drugs/0021.html
- 医薬品の承認申請について(2014年11月21日付け、医薬局長通知):https://www.mhlw.go.jp/file/06-Seisakujouhou-11120000-Iyakushokuhinkyoku/0000092759.pdf
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法):https://laws.e-gov.go.jp/law/335AC0000000145


コメント